|
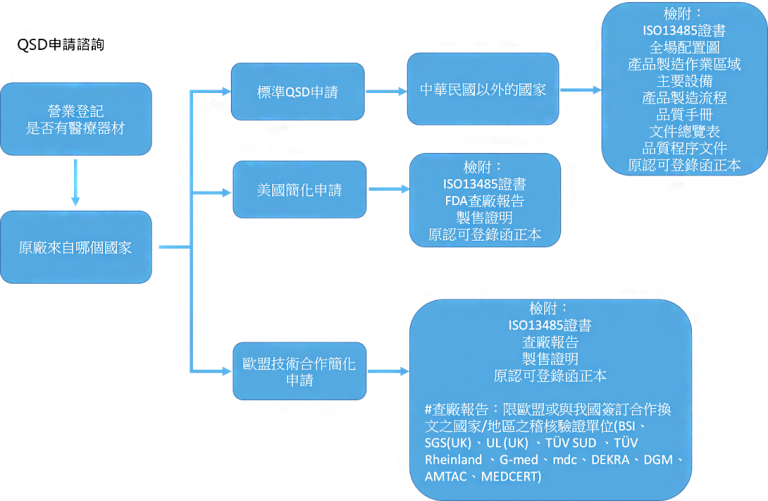
在台灣會詢問 QSD的,絕大部分是貿易商。 在前端諮詢時,我們最常聽到的就是:要怎麼申請 QSD,顧問你們有在協助嗎? 簡單釐清一些基本觀念: 衛署醫器製字第 XXXXXX 號(國產醫療器材)>這是 GMP 衛署醫器輸字第 XXXXXX 號(進口醫療器材)>這是 QSD
那在國外製造,我們要怎樣要求該廠可以吻合我們 GMP 要求呢? 難道要輸入國外醫療器材,我們的查驗單位就要飛去國外驗廠嗎? 基於 GMP 是參照 ISO 13485 的架構,故此,QSD 要吻合台灣 GMP 要求,那就是請國外醫療器材原廠提出證明,證明的依據就是「ISO 13485 的證書」。 而 QSD 的申請方案有分3種:美國簡化模式、歐盟技術合作簡化方案、QSD 申請標準模式,這三個申請方案的不同之處,也就是需檢附的資料多寡以及您的原廠設在哪裡。 總結,所以在申請 QSD 前需要先確認的 3件事: 1. 你們的營業登記是否有包含醫療器材? 2. 你們的原廠是在哪個國家?(辨別國家) 3. 依據國家提出需要的相關佐證文件 以下為 QSD 申請的架構流程圖: 評論已關閉。
|
作者寫一些關於自己的事。不必花俏,簡單描述即可。 封存檔
六月 2024
類別 |



 RSS 訂閱
RSS 訂閱
5/10/2020